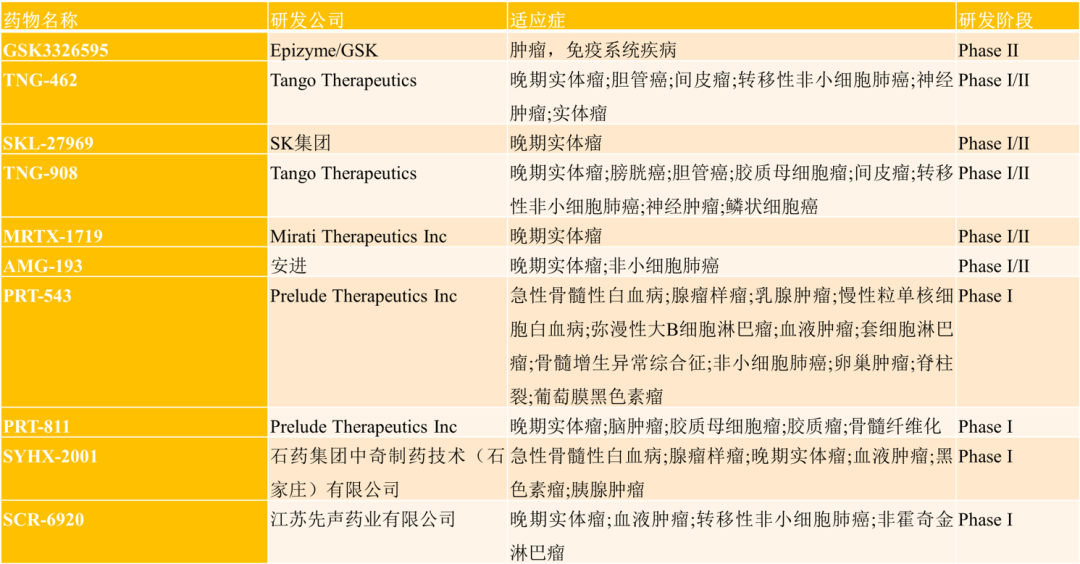
**和誉-B:新型PRMT5*MTA抑制剂ABSK131的IND申请获中国CDE批准**
2025年3月6日,上海和誉生物医药科技有限公司对外宣布,其研发的高选择性小分子PRMT5*MTA抑制剂ABSK131的临床研究申请,已经正式获得了中国国家药品监督管理局药品审评中心(CDE)的批准。这一消息的发布,标志着ABSK131在国内的临床研究进入了实质性阶段,为这一创新药物在未来的研发道路上奠定了坚实的基础。
ABSK131作为和誉生物医药科技有限公司的重点研发项目,一直备受业界关注。这款药物是一种新型PRMT5*MTA抑制剂,其独特的机制使得它能够在MTAP基因缺失的肿瘤细胞中发挥“合成致死”效应,从而选择性杀伤这些肿瘤细胞。这一特性使得ABSK131在针对特定类型的实体瘤方面具有显著的治疗潜力。
MTAP基因缺失是一种在多种实体瘤中常见的现象,包括非小细胞肺癌、胰腺癌、食管癌、间皮瘤和胃肠癌等。这些肿瘤类型中的MTAP缺失发生率较高,而现有的治疗手段对于这些MTAP缺失的肿瘤往往效果不佳。因此,ABSK131的研发成功,为这些患者带来了新的治疗希望。
值得注意的是,ABSK131不仅在治疗MTAP缺失的肿瘤方面具有潜力,其临床前数据还显示出了该药物在抗脑转移瘤方面的可能性。这一发现进一步拓宽了ABSK131的应用前景,使得它在未来的临床研究中具有更多的探索空间。
在获得CDE批准之前,ABSK131的IND申请已经于2024年12月初获得了美国FDA的批准。这一系列的批准,充分说明了国内外监管机构对于ABSK131研发价值和潜力的认可。同时,也为和誉生物医药科技有限公司在全球范围内的药物研发提供了更多的信心和动力。
接下来,和誉生物医药科技有限公司将在晚期实体瘤患者中开展一项名为“一项评估ABSK131在晚期/转移性实体瘤患者中的安全性、耐受性、药代动力学和初步有效性的I期、首次人体、多中心、开放性研究”的临床研究。该研究将主要聚焦于MTAP基因缺失的患者,旨在全面评估ABSK131在这些患者中的安全性和有效性。
对于和誉生物医药科技有限公司而言,ABSK131的研发成功不仅意味着公司在创新药物研发领域取得了重大突破,更代表了公司在肿瘤治疗领域迈出了坚实的一步。未来,随着ABSK131临床研究的不断深入,相信它将为更多的肿瘤患者带来福音。
值得一提的是,ABSK131作为第二代小分子PRMT5/MTA协同抑制剂,相较于第一代药物在机制上进行了优化。它可以区分PRMT5*MTA与游离PRMT5,从而降低毒性并拓宽治疗窗口,提升成药性。这一特点使得ABSK131在临床试验中具有更高的安全性和有效性,为患者提供了更好的治疗选择。
此外,ABSK131在细胞活性、选择性和入脑性方面均表现出色。在2024年的国际分子靶标与癌症治疗大会(ENA大会)上,ABSK131被列为了潜在的BIC药物。这一荣誉不仅是对ABSK131研发成果的肯定,更是对其未来市场前景的看好。
随着ABSK131在国内临床研究的不断推进,相信它将在不久的将来为中国的肿瘤患者带来新的治疗选择。同时,和誉生物医药科技有限公司也将继续加大在创新药物研发领域的投入,为全球肿瘤患者提供更多的优质药物和治疗方案。
总之,ABSK131的IND申请获得中国CDE批准是和誉生物医药科技有限公司在创新药物研发领域取得的又一重要里程碑。这一成果不仅为公司的发展注入了新的活力,更为全球肿瘤患者带来了新的希望。未来,随着ABSK131临床研究的不断深入和拓展,相信它将在肿瘤治疗领域发挥更加重要的作用。
转载请注明来自刘敏,本文标题:《和誉-B ABSK131:中国CDE批准PRMT5*MTA新型抑制剂IND申请》







 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号